中國(guó)藥典或?qū)⑿抻喩镏破分гw檢測(cè)標(biāo)準(zhǔn)
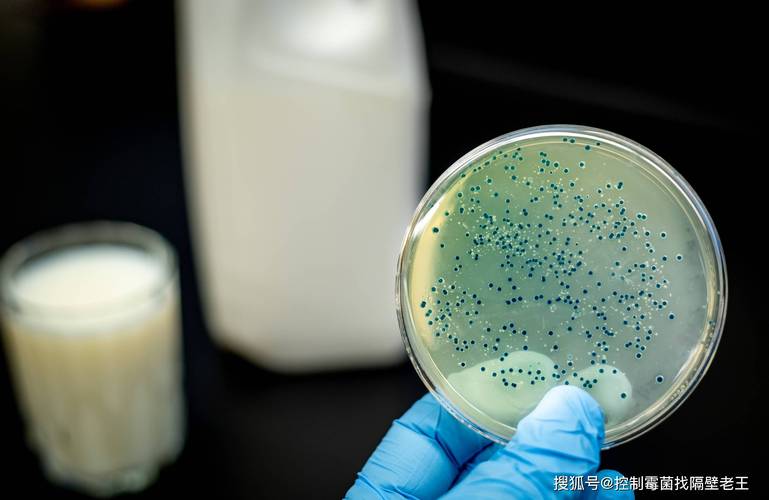
近年來(lái),隨著生物制品在醫(yī)藥領(lǐng)域的廣泛應(yīng)用,其質(zhì)量控制與安全性問(wèn)題日益受到關(guān)注。支原體作為一種常見(jiàn)的微生物污染源,可能?chē)?yán)重影響生物制品的質(zhì)量和患者安全。目前,中國(guó)藥典對(duì)生物制品中支原體檢測(cè)的規(guī)定主要依據(jù)傳統(tǒng)培養(yǎng)法,但該方法存在檢測(cè)周期長(zhǎng)、靈敏度有限等局限。
隨著生物技術(shù)的快速發(fā)展,新型檢測(cè)方法如PCR技術(shù)、熒光染色法等已展現(xiàn)出更高的準(zhǔn)確性和效率。國(guó)際藥品監(jiān)管機(jī)構(gòu)如美國(guó)藥典和歐洲藥典已逐步引入這些先進(jìn)技術(shù)。因此,中國(guó)藥典可能面臨修訂,以納入更靈敏、快速的支原體檢測(cè)方法,從而提升生物制品的質(zhì)量控制水平。
此次修訂可能涉及檢測(cè)方法的更新、驗(yàn)收標(biāo)準(zhǔn)的調(diào)整以及驗(yàn)證流程的優(yōu)化。例如,引入核酸擴(kuò)增技術(shù)作為補(bǔ)充或替代方法,可縮短檢測(cè)時(shí)間并提高對(duì)難培養(yǎng)支原體的檢出率。同時(shí),修訂可能強(qiáng)化對(duì)原材料、生產(chǎn)過(guò)程和終產(chǎn)品的全程監(jiān)控,確保生物制品從源頭到成品的無(wú)菌性。
這一變化將推動(dòng)生物制藥行業(yè)的技術(shù)升級(jí),促進(jìn)國(guó)內(nèi)產(chǎn)品與國(guó)際標(biāo)準(zhǔn)接軌,最終保障公眾用藥安全。相關(guān)企業(yè)和監(jiān)管機(jī)構(gòu)需密切關(guān)注修訂進(jìn)展,并及時(shí)調(diào)整生產(chǎn)與檢驗(yàn)流程。
如若轉(zhuǎn)載,請(qǐng)注明出處:http://www.3g93.cn/product/12.html
更新時(shí)間:2026-01-23 05:04:11